Viss par osmiju

Osmijs - rets metāls, pieder pie platīna grupas. Tas tika atklāts Anglijā, veicot eksperimentus par platīna reakciju. Nosaukums osmijs ir dots grieķu valodā un tulkojumā nozīmē "smarža". Kāds ir šis cēlmetāls? Kādas ir tās īpašības un kāda ir tā izmantošana?

Vēsture
Šo elementu 1803. gadā nejauši atklāja angļu ķīmiķi Smitsons Tenants un Viljams H. Volastans. Eksperimentu rezultātā par platīna reakciju uz skābju (sērskābes un slāpekļa) maisījumu radušās nogulsnes radīja nepatīkamu aromātu, kas atgādināja hlora un sapuvušu redīsu smaku. Līdzīgus eksperimentus veica Colle-Descoti, Antoine de Fourcoy un Vauquelin Francijā. Pētījumu rezultātā viņi arī atrada nezināmu vielu nešķīstošajos platīna nogulumos.



Toreiz nezināmā viela tika nosaukta par cāli, taču britu eksperimenti pierādīja, ka tās ir divas līdzīgas vielas - irīdijs un osmijs.
Šo ķīmisko elementu atklāšanu Londonas Karaliskajai biedrībai iepazīstināja ar Tenanta rakstisku paziņojumu, kas datēts ar 1804. gada 21. jūniju. Mendeļejeva ķīmisko elementu periodiskajā tabulā metāls atrodas zem kārtas skaitļa 76. Metāls tīrā veidā nenotiek tīrradņu veidā, tāpēc tā ķīmiskā formula ir izšķīdināta.


Elements tiek iegūts no otrreizējām izejvielām tā atdalīšanas rezultātā no irīdija, platīna, platīna-palādija rūdām vai vara un niķeļa rūdām. Visa elementa gada produkcija pasaulē nepārsniedz 1 tonnu.


Dzimšanas vieta
Pasaules lielākās atradnes ir vērts atzīmēt tādas zonas kā Urālu kalni un Sibīrija Krievijā, ziemeļu štatā Aļaska un rietumu štatā Kalifornija Amerikā, Kanāda Ziemeļamerikā, Kolumbija Dienvidamerikā un dažos Dienvidāfrikas valstis, Austrālija, sala Tasmānija... Pašlaik tiek apsvērta ievērojama osmija atradne Bušvelas komplekss Dienvidāfrikā, tur tiek iegūta lielākā daļa vielas. Ņemot vērā, ka lielākās metāla atradnes ir Dienvidāfrikā, pasaules cenas šim retzemju metālam ir diezgan augstas. Kazahstāna tiek uzskatīts par vienīgo lielāko osmija-187 eksportētāju pasaulē. Lai gan Ķīnā ir platīna rūdas rezerves, tajā nav ievērojama osmija daudzuma.


Viela tiek uzglabāta pulvera veidā, un, tā kā tā nekūst kristālu veidā, tai nav iespējams uzlikt zīmogu tās fizikālo īpašību dēļ. Šī metāla lietņu ražošanai tiek izmantota elektronu staru vai loka karsēšana no pulvera, tiek izmantota arī karsēšana tīģelī.


Īpašības
Osmijs izskatās kā sudrabaini zilgans metāls. Tas ir viens no blīvākajiem elementiem, tā blīvums ir 22 600 kilogrami uz kubikmetru, bet tajā pašā laikā viela ir diezgan trausla, viegli lūzt un drūp. Tam ir augsts īpatnējais svars un tas spēj spīdēt pat diezgan augstas temperatūras ietekmē. Tā parametru un ievērojamās kušanas temperatūras dēļ to ir grūti apstrādāt. Dabā tas pastāv septiņu izotopu veidā, no kuriem seši tiek uzskatīti par stabiliem, tie ir osmijs-184, osmijs-187, osmijs-188, osmijs-189, osmijs-190 un osmijs-192. Laboratorijā tika iegūti radioaktīvie metālu izotopi ar masas skaitļiem no 162 līdz 197, kā arī mākslīgi iegūti daži kodolizomēri.
Osmijs pēc savām īpašībām nelabvēlīgi ietekmē visus dzīvos organismus.

Gandrīz visi savienojumi ar šo metālu izraisa iekšējo orgānu bojājumus, redzes un dzirdes traucējumus. Saindēšanās gadījumā ar osmija tvaikiem var rasties neatgriezeniski traucējumi organismā un nāve. Zinātnieki veica eksperimentus ar dzīvniekiem, kuru rezultāti bija strauja anēmijas attīstība, normālas plaušu funkcijas trūkums. Secināts, ka tā ir strauji attīstoša tūska. Osmija tetroksīds, ko izmanto medicīnā, ir ļoti kodīga viela. Tam ir visnejaukākā smaka pasaulē. Saindēšanās gadījumā cieš āda, tā maina krāsu uz zaļu vai melnu, bieži vien kopā ar čūlām un plaisām, kuru dzīšana prasīs ļoti ilgu laiku.

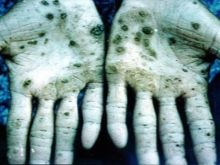

Ražotņu darbinieki ir pakļauti visaugstākajam riskam, saskaņā ar visiem drošības standartiem viņi strādā tikai respiratoros un speciālā apģērbā. Visi konteineri, kas satur osmija oksīdu, ir noslēgti un uzglabāti saskaņā ar noteikumiem. Lai iegūtu nevjanskīta minerālus, platīnu pārvērš šķīdumā, izmantojot ūdens regiju. Pēc tam iegūtās nogulsnes tiek pakļautas cinka iedarbībai 8-kārtīgā daudzumā – šāds sakausējums salīdzinoši viegli pārvēršas pulverveida stāvoklī, kas pēc tam tiek sakausēts ar bārija peroksīdu. Nākamais posms ir iegūtās masas apstrāde ar Aqua Regia, destilācija caur osmija tetroksīda atdalīšanas aparātu.

Iedarbojoties uz vielu ar sārma šķīdumu, tiek iegūts sāls. Tiek ietekmēts sāls šķīdums hiposulfīts, kā rezultātā ar amonija hlorīda palīdzību metāls izgulsnējas jau Fremy sāls veidā. Nogulsnes mazgā, filtrē un kalcinē. Visu šo darbību rezultāts ir porains osmijs. Pēc tam to attīra ar skābēm, reducē elektriskā krāsnī zem ūdeņraža plūsmas un atdzesē. Tātad iegūt osmija paraugus līdz 99,9%.


Ķīmiskā
Šī elementa īpašības no ķīmijas viedokļa ir pārsteidzošas. Visvienkāršākie no tiem ir šādi.
- Osmijs vispār nereaģē ar sārmiem un skābēm. Reakcijā ar sārmainiem kausējumiem veido ūdenī šķīstošus osmātus. Mijiedarbība ar slāpekļskābes un sālsskābes maisījumu rada ārkārtīgi lēnu reakciju.
- Ļoti toksisks, pat mikroskopiskās devās. Īpaši toksisks ir osmija oksīds, kas izdalās no platīna.
- Metāla viršanas temperatūru nav iespējams noteikt, jo tas ir īpaši ugunsizturīgs.
- Pulverī esošais metāls viegli nonāk karsēšanas reakcijā ar šādām vielām: tīru skābekli, halogēniem, sērskābi vai slāpekļskābi.
- Dažādos savienojumos tiek iegūti oksīdu skaitļi no -2 līdz +8. Visizplatītākie ir +2, +3, +4 un +8.
- Spēj veidot klasteru savienojumus.
- Galvenie minerāli ir saistīti ar cietiem šķīdumiem, un tos attēlo irīdija sakausējumi ar osmiju - tie ir sisertskīts un nevjanskīts. Turklāt siserskītam ir atšķirīgs nosaukums - īdīgs osmijs, bet nevjanskītam - osmousais irīdijs.

Fiziskā
Blīvums osmijs ir aptuveni 22,61 grami uz kubikcentimetru. Kristāliem ir skaists sudrabains spīdums ar dažādiem toņiem no pelēka līdz zilam. Lietos parādās tumši zila krāsa, pulverī tā ir violeta. Visam metālam ir sudrabains spīdums. Elementa toksicitāte neļauj to izmantot juvelierizstrādājumu rūpniecībā. Galvenās fizikālās īpašības ir šādas.
- Šī elementa kušanas temperatūra ir diezgan augsta, kušana ir iespējama temperatūrā virs 3000 grādiem pēc Celsija.
- Metālam nav magnētisku īpašību.
- Apbrīnojama stingrība. Sakausējumi ar šī metāla pievienošanu iegūst paaugstinātu nodilumizturību, izturību, izturību pret koroziju un izturību pret mehānisko spriegumu.
- Viršanas temperatūra ir 5012 ºC.
- Mosa cietība ir 7.
- Vickers cietība ir 3-4 GPa.

Lietojumprogrammas
Paša elementa ievērojamo izmaksu dēļ šis metāls tiek reti izmantots masveida rūpnieciskajā ražošanā. Osmiju galvenokārt izmanto ķīmiskajā rūpniecībā, kur to izmanto kā katalizatoru. Osmija tetroksīdu lieto dažās zālēs. Laboratorijas analīzēs izmanto dzīvo audu krāsošanai, nodrošina šūnu struktūras saglabāšanu.
Aviācijas un kosmosa rūpniecībā izmanto osmiju aviācijas un raķešu tehnoloģiju iekārtu elektroniskajā aprīkojumā, kā arī ražošanā atomieroči. Magnētisko īpašību trūkuma dēļ metālu izmanto zīmolu pulksteņu, piemēram, Rolex, ražošanā. Osmija sakausējums ar platīnu tiek izmantots, kad ķirurģisko implantu izveide Ir elektrokardiostimulatori vai plaušu vārsti.
Turklāt osmiju izmanto mikroskopijā un augstas precizitātes instrumentu radīšanai.



Interesanti fakti
- Zem spiediena aptuveni 770 GPa osmijā elektroni mijiedarbojas iekšējās orbitālēs, vielas struktūra paliek nemainīga.
- Osmijs iežos satur pusprocentu no kopējās rūdas atradņu masas.
- Lielā blīvuma dēļ metāla izskats un faktiskais svars ļoti atšķiras. Tātad 0,5 litru plastmasas pudele, kas pildīta ar šo metāla pulveri, būs smagāka nekā 10 litru spainis, kas piepildīts ar ūdeni.
- Šis metāls ir pieciniekā dārgi.
- Trīskāršās osmija unces izmaksas ir komercnoslēpums, atklātajos avotos var atrast aptuveno cenu par 1 gramu vielas.
- Osmija ugunsizturības dēļ atzīmēts elektriskās lampas vēsturē. Zinātnieks K. Auers fon Velsbahs no Vācijas izteica priekšlikumu spuldzes oglekļa pavedienu aizstāt ar osmija pavedienu. Spuldzes izrādījās 3 reizes mazāk energoietilpīgas, un apgaismojums ir ievērojami uzlabojies. Tiesa, to drīz vien nomainīja biežāk sastopamais tantals, kas savukārt tika aizstāts ar volframu.
- Līdzīga situācija notika ar reto metālu amonjaka ražošanā. Amonjaka sintēzes metode, kas tiek izmantota arī mūsdienās, ko 1908. gadā izstrādāja ķīmiķis Frics Hābers no Vācijas, nav iespējama bez katalizatoru izmantošanas.Sākotnēji tolaik izmantotie katalizatori savas īpašības parādīja tikai ievērojamu temperatūras apstākļu klātbūtnē un tiem nebija augstas efektivitātes, tāpēc nomaiņas meklēšana bija ļoti steidzama. Zinātnieki no Karlsrūes Augstākās tehniskās skolas laboratorijas izteica priekšlikumu par katalītisko elementu izmantot smalki izsmidzinātu osmiju. Testa rezultāti apstiprināja, ka šī ideja ir vērtīga, katalītiskā temperatūra ir pazeminājusies par vairāk nekā 100 ºC, un ievērojami palielinājusies amonjaka izdalīšanās. Tiesa, nākotnē viņi atteicās no osmija, bet viņš palīdzēja atrisināt tik svarīgu problēmu.

Spēlē osmijs un citi reti un unikāli metāli nozīmīga loma dažādās nozarēs... Pat ar visu savu toksicitāti tas glābj cilvēku dzīvības un veselību.
Lai iegūtu papildinformāciju par osmiju, skatiet šo videoklipu.








